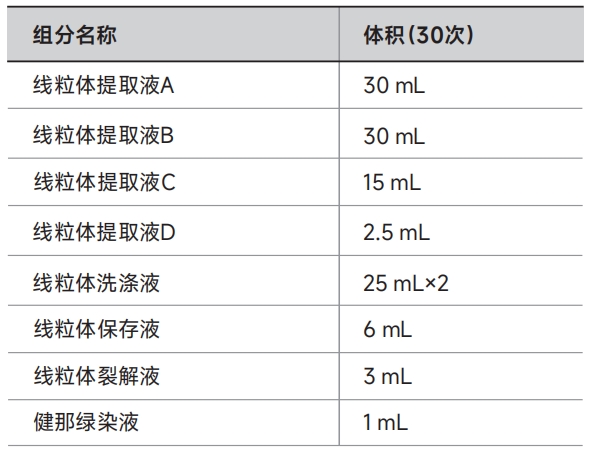
本产品在 60 min 内即可分离出完整的线粒体,获得的线粒体具有完整的双层膜结构和很高的生物学活性,可用 于细胞凋亡、信号转导和代谢研究等下游应用以及线粒体蛋白质组学研究。此外,提取的线粒体经裂解液裂解后即可 得到线粒体蛋白,可用于线粒体蛋白分析、SDS-PAGE、WB、IP 等实验。本产品可兼容动物组织及动物细胞中线粒体的 提取,当样品为 100 mg 组织或 2×107 个细胞,本试剂盒可以处理 30 个样品。
纯度高
利用两步密度梯度离心的原理,提取到的线粒体纯度更高活性高
所提取的线粒体保留有完整的结构,并具有很高的生物学活性应用广
本产品提取的线粒体可应用于:玻璃匀浆器、4℃离心机(离心力需达到 21,000×g)
将试剂盒各组分置于冰上,使用时需进行无菌操作,将离心机、玻璃匀浆器 4℃预冷;
样品准备:
组织样品 将新鲜组织样品用适量预冷的 1×PBS(货号:PS110)清洗,取 100mg 组织加入到合适大小的匀浆器中,加入 1mL 线粒体提取液 A;
注意:请勿使用经冷冻保存的组织样品。
细胞样品 离心 5 min(500×g,4℃)收集细胞,用适量预冷的 1×PBS 重悬细胞,取 2×107 个细胞,离心 5 min(500×g,4℃)后弃尽上清,加入 1 mL 线粒体提取液 A 重悬细胞,并转至合适大小的匀浆器中。
将样品匀浆多次,直至 细胞破碎比例 达到 50%~60% 即可停止匀浆;
注意:细胞破碎程度是提取线粒体能否成功的关键,细胞破碎不足会影响线粒体的产量,细胞破碎过度则会影响 线粒体结构的完整性。建议提前做预实验探索细胞破碎条件,推荐方案如下:
组织样品 匀浆 5~10 次左右,取匀浆悬液与台盼蓝染液混合,观察细胞破碎情况;
细胞样品 需要间隙严密的研杵方能达到破碎效果,匀浆 5 次后,取匀浆悬液与台盼蓝染液混合,根据破碎情况适当增加匀浆次数。请勿过度匀浆!
在 2 mL EP 管中加入 1 mL 线粒体提取液 B,沿管壁缓慢地加匀浆液使其覆盖于上层(此时出现分层现象),立即 4℃离心 10 min(组织样品 700×g,细胞样品 600×g)。收集 1 mL 最上层分离层至 1.5 mL EP 管中;
注意:离心后上清会分成两层,收集最上层分离层。如果分层不明显则将所有上清收集。
将分离层溶液离心 10min(10,000×g,4℃),弃尽上清,沉淀即为粗线粒体,用 0.5mL 线粒体洗涤液重悬;
在预冷的 1.5 mL EP 管中分别加入 425 μL 线粒体提取液 C 和 75 μL 线粒体提取液 D(即体积比 C:D=17:3,现用 现配),充分混匀;
将重悬的粗线粒体缓慢地加入步骤 6 中混合液的上层,立即离心 10 min(21,000×g,4℃),弃尽上清。
注意:离心机应在 15 sec 以内达到相应转速,否则会影响分离效果。
加入 1 mL 的线粒体洗涤液重悬沉淀,离心 5 min(16,000×g,4℃),收集沉淀,沉淀即为高纯度的线粒体;
线粒体使用:
⑴向沉淀中加入 200 μL 线粒体保存液重悬,吹打混匀后,可用于完整线粒体的功能或酶活性研究;
⑵向沉淀中加入 100 μL 线粒体裂解液(可在裂解液中按 1:100(V/V) 加入 100× 蛋白酶抑制剂〈货号 GRF101〉) 重悬,吹打混匀后,即得到线粒体蛋白,可用于 SDS-PAGE、WB、IP、Co-IP 等后续实验。
线粒体染色鉴定:取 5μL 用线粒体保存液重悬的线粒体,与 5μL 健那绿染液混匀后,滴加在载玻片上,盖上盖 玻片,于显微镜下观察。可观察到线粒体呈现出蓝绿色小棒状或哑铃状。
1. 提取全程请低温无菌操作,样品管需放在冰浴中;
2. 在不破坏亚细胞器的情况下破碎细胞是制备线粒体的关键,破碎效果与组织细胞类型有关,不同型号匀浆器的破碎效果也不同;
3. 处理细胞样品时破碎步骤较为关键,解决方案有:
(1)选用间隙严密的研杵。将研杵插入匀浆器套管后,可提起研杵而套管不会脱落;
(2)使用超声破碎仪破碎。可选用最低功率,探索破碎条件;
4. 用线粒体保存液重悬线粒体后,请及时使用。如无法及时使用,建议 -80℃保存。冻存后的线粒体样品不推荐用于完整线粒体功能的研究,但可以用于线粒体蛋白分析、WB、IP 等实验;
5. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
6. 本产品仅限科研使用。
总篇数:加载中...
总影响因子:加载中...
最高影响因子:加载中...