本产品可以将所有类型的慢病毒颗粒进行浓缩,操作简单快捷。
1. 取慢病毒原液,加入慢病毒浓缩液(5×)至1×浓度(例如:在800μL慢病毒原液中需加入200μL 5×慢病毒浓缩液),迅速摇晃15~20次,使其充分混匀。将混合液离心(4℃,12,000~16,000×g,2min),管底可见白色沉淀;
2. 离心后充分去除上清(为防止浓缩液残留,请将上清除去后,二次离心,充分除净上清),向沉淀加入目的培养基重悬,添加量由所需浓缩的倍数决定(例如:原始800μL慢病毒原液所得沉淀使用80μL培养基重悬,可获得10倍浓度的慢病毒悬液),重悬后的慢病毒悬液可直接用于慢病毒感染或冻存于-80℃。
注意:若慢病毒原液浓缩离心后无沉淀出现,可能的原因如下:
①若慢病毒原液浓度在1×106 TCID50/mL左右,存在看不见沉淀的情况,属于正常现象,可继续实验;
②慢病毒原液浓度过低,详见下文功能测试。
对含有GFP基因的慢病毒液(浓度分别为5×106,5×105,5×104 TCID50/mL)进行浓缩测试(下图),使用慢病毒浓缩液进行10或100倍浓缩。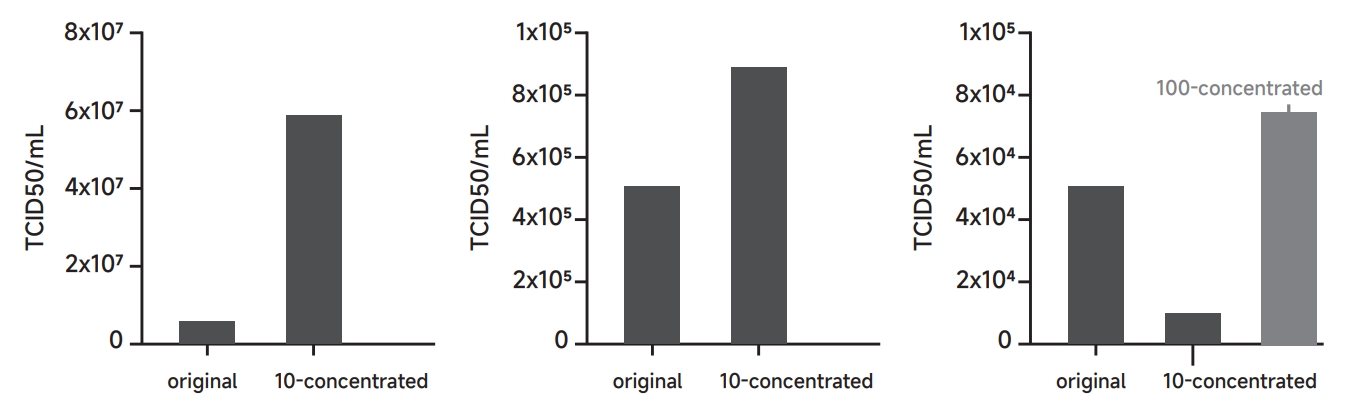
由图可知:
①当慢病毒原液浓度≥5×106 TCID50/mL时,浓缩后损失率小于5%;
②5×105 TCID50/mL≤慢病毒原液浓度<5×106 TCID50/mL时,浓缩效果明显下降;
③1.0×104 TCID50/mL≤慢病毒原液浓度<1.0×105 TCID50/mL时,推荐进行100倍浓缩,有一定的浓缩效果;
④当慢病毒原液浓度<1.0×104 TCID50/mL时,不推荐使用浓缩液进行浓缩。
1. 实验过程中需穿戴实验服、一次性手套及口罩。请勿随意丢弃病毒接触过的物品,并尽可能使用甲醛等灭活剂和紫外照射进行处理;
2. 本产品仅限科研使用。
总篇数:加载中...
总影响因子:加载中...
最高影响因子:加载中...