本产品是一款基于T7 RNA聚合酶的RNA体外转录试剂盒,其可以含有T7启动子序列的线性双链DNA为模板,以NTPs为底物,从T7启动子下游开始合成与模板DNA中一条链互补的RNA,短时间内即可获得大量的RNA分子。此外,转录时也可在底物中添加修饰后的核苷酸,制备生物素或染料标记的RNA。
本试剂盒可兼容长转录本和短转录本的合成,添加0.5μg DNA模板,即可收获100-200μg RNA,其转录合成的RNA可用于体外翻译、反义RNA和RNAi以及RNA剪接等相关研究。
一、模版制备
带有双链T7启动子的PCR产物、线性化质粒以及合成的DNA片段均可作为本产品的体外转录模板,模板可用TE缓冲液或RNase-free ddH2O进行溶解(推荐浓度为0.5μg/uL)。
PCR产物模板(每个反应推荐用量为0.3~0.5μg)
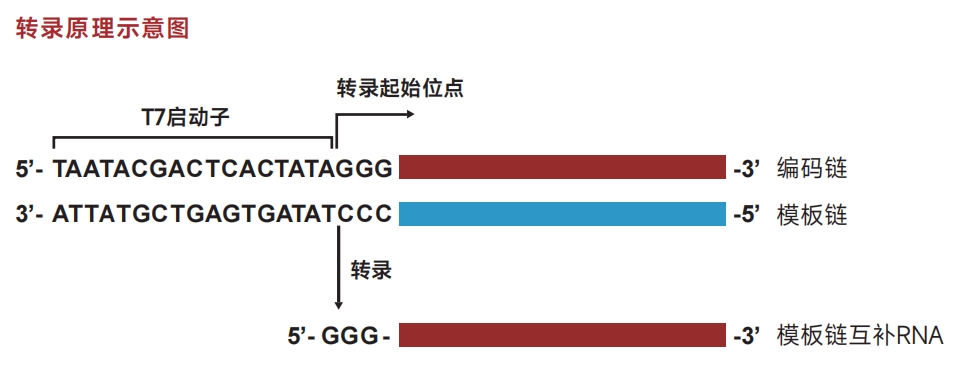
PCR扩增模板DNA时,将T7启动子序列(TAATACGACTCACTATAGGG)预先加在非编码链上游引物的5'端,即可扩增得到带有T7启动子的PCR产物,经电泳确认其单一性后,即可作为体外转录模板。
线性化质粒模板(每个反应推荐用量为1μg)
带T7启动子的线性化质粒可作为体外转录模板,需确保其双链为平末端或编码链5'端为突出结构,且质粒的线性化程度和纯度会影响转录的产量及RNA的完整性。
注意:质粒线性化后,需经过纯化方可作为体外转录模板,以避免RNase、RNA、蛋白及盐残留对反应体系的干扰。
合成的DNA模板(每个反应推荐用量为0.3~0.5μg)
合成的带有T7启动子的DNA片段也可以作为体外转录的模板。
二、体外转录
进行体外转录实验操作,需佩戴一次性手套和口罩,并使用无核酸酶耗材和试剂,以避免引入RNase污染。
1. 将除T7 RNA Polymerase Premix外的其它组分振荡混匀,短暂离心收集于管底,置于冰上备用;
2. 按下表配制反应体系(根据DNA模板的长度确定其用量,推荐用量为0.3~1μg):

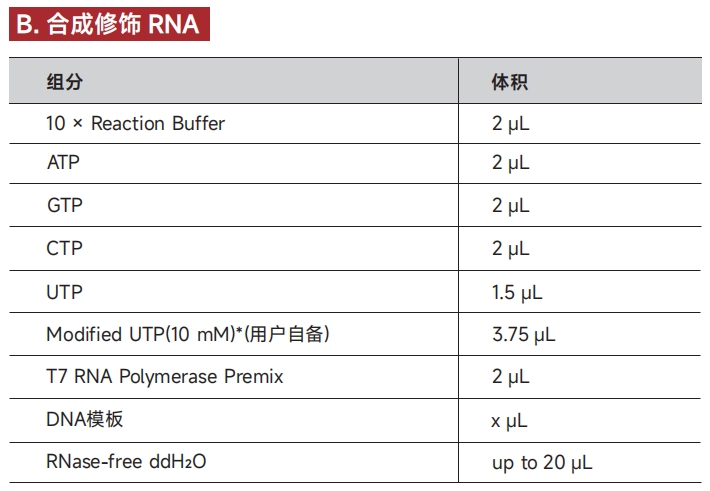
*体系以Modified UTP为例,若使用其它Modified NTP底物,可参照UTP Solution与Modified UTP比例配制反应体系。
3. 用移液器轻柔混匀各组分,并短暂离心收集于管底,37℃孵育2h;
注意:① 建议在PCR仪中进行反应,将热盖打开,以避免蒸发对反应体系造成影响;
②可根据产物片段大小调整反应时长,如RNA产物小于300bp,可延长反应至4h或更长时间,16h过夜反应对产物质量无影响。
4. (可选)在反应体系中加入1μL DNaseⅠ,37℃孵育15min,去除DNA模板;
注意:相对于产物RNA,模板DNA的含量非常低,一般不用去除。
5. RNA产物经电泳分析及纯化后,即可用于下游实验。
注意:产物浓度极高,需用RNase-free ddH2O稀释后再检测。
三、RNA纯化
1. 向转录体系中加入等体积的Lithium Chloride Solution,混匀,12,000×g 离心2min,小心吸弃上清;
2. 向离心管中加入200μL 75%乙醇,12,000×g离心2min,小心吸弃上清;
3. 重复上一步操作;
4. 吸弃上清后,将离心管开盖室温置于通风处5min,以确保彻底去除残留的乙醇;
5. 加入 30~50 uL 的 RNase-free ddH2O 溶解 RNA。
注意:产物 RNA 纯化也可根据情况选择酚 / 氯仿纯化法或柱纯化法。
四、RNA定量
可选择以下方法进行RNA定量:
紫外吸收法:游离核苷酸会影响定量的准确性,定量前请先对RNA产物进行纯化;
染料法:用RiboGreen染料进行RNA定量,游离核苷酸不会影响定量,可以对纯化或未纯化的RNA产物进行准确定量。
五、结果验证
在标准体外转录反应体系中分别加入0.5kb、1.0kb、2.0kb以及3.0kb的DNA模板各0.5μg,37℃孵育2h,反应结束加入1μL DNase Ⅰ,37℃孵育15min。最后进行RNA产物纯化,并通过核酸凝胶电泳进行检测,结果如下。

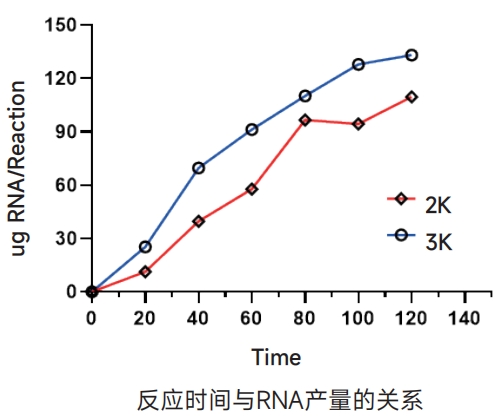
在标准体外转录反应体系中分别加入2.0kb和3.0kb的DNA模板各0.5μg,每隔20min对RNA转录产率进行统计,对于长片段DNA模板的体外转录,通常反应2h即可得到100μg以上的RNA。
1. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
2. 本产品仅限科研使用。
总篇数:加载中...
总影响因子:加载中...
最高影响因子:加载中...