细胞凋亡(Apoptosis)是最常见的细胞死亡方式之一,其受到基因的严格调控。细胞凋亡过程常伴随着明显的细胞形态学变化,比如,细胞凋亡早期,质膜内侧的磷脂酰丝氨酸(phosphotidylserine,PS)会翻转到细胞质膜表面;而在凋亡的中后期,随着细胞质膜的通透性的增大,一些较大分子的化合物,如碘化丙啶(Propidium Iodide,PI,一种DNA结合染料),便可自由扩散进入细胞,将细胞核染上红色荧光。
Annexin V(膜联蛋白-V)是一种分子量为35~36kDa的Ca2+依赖性磷脂结合蛋白,能与磷脂酰丝氨酸高亲和力特异性结合。本试剂盒采用绿色荧光FITC标记的Annexin V作为检测磷脂酰丝氨酸的探针,配合碘化丙啶(PI),通过使用流式细胞仪、荧光显微镜或其它荧光检测设备,可以快速检测细胞凋亡。Annexin V-FITC凋亡检测试剂盒对细胞群进行染色后,早期凋亡细胞显示绿色荧光,晚期凋亡细胞及坏死细胞显示红色和绿色荧光,活细胞几乎没有荧光。
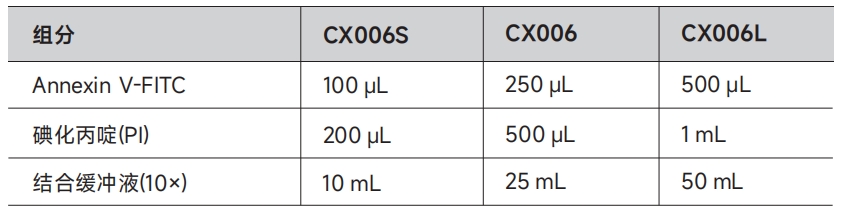
对于悬浮细胞
1. 用无菌去离子水将结合缓冲液(10×)稀释成1×结合缓冲液;
2. 离心收集细胞(500~1,000×g,5min);
3. 加入预冷的PBS(pH7.4)轻轻重悬细胞,用移液器轻柔吹打洗涤,离心收集细胞,共洗涤两次;
4. 用1×结合缓冲液重悬细胞,使细胞浓度达到1×106cells/mL;
5. 吸取100μL细胞悬液(细胞总数为1×105cells)至一新EP管中,加入5μL Annexin V-FITC和5~10μL碘化丙啶(PI),轻轻混匀,室温避光孵育10~15min;
6. 染色孵育后,每管加入800μL 1×结合缓冲液,轻轻混匀,离心(500×g,5min),去上清;
7. 向管中加入100μL或合适上样体积的1×结合缓冲液,轻轻重悬细胞,立即进行流式细胞仪检测。 如用于荧光显微镜检测,可涂片后,在荧光显微镜下进行观察。
对于贴壁细胞
1. 用无菌去离子水将结合缓冲液(10×)稀释成1×结合缓冲液;
2. 首先将细胞培养液吸出至一新离心管内,接着用预冷的PBS(pH7.4)轻柔地洗涤贴壁细胞一次,加入适量胰酶细胞消化液(不含EDTA),室温孵育至轻轻吹打可以使贴壁细胞脱落下来即可,吸除胰酶细胞消化液。需避免胰酶的过度消化,以免造成假阳性;
3. 在细胞中加入上一步骤收集的细胞培养液,稍混匀,转移至离心管内,离心(500~1,000×g,5min),弃上清,收集细胞:
注意:加入步骤1中的细胞培养液一方面可以收集已经悬浮的发生凋亡或坏死的细胞,另一方面细胞培养液中的血清可以有效抑制或中和残留的胰酶;残留的胰酶会消化并降解后续加入的Annexin V-FITC导致染色失败。
4. 加入预冷的PBS(pH7.4)轻轻重悬细胞,用移液器轻柔吹打洗涤,离心收集细胞,共洗涤两次;
5. 用1×结合缓冲液重悬细胞,使细胞浓度达到1×106cells/mL;
6. 吸取100μL细胞悬液(细胞总数为1×105cells)至一新EP管中,加入5μL Annexin V-FITC和5~10μL碘化丙啶(PI),轻轻混匀,室温避光孵育10~15min;
7. 染色孵育后,每管加入800μL 1×结合缓冲液,轻轻混匀,离心(500×g,5min),去上清;
8. 向管中加入100μL或合适上样体积的1×结合缓冲液,轻轻重悬细胞,立即进行流式细胞仪检测。 如用于荧光显微镜检测,可涂片后,在荧光显微镜下进行观察。
1.
流式检测需设置三个对照样品来校准:
空白管:仅用1×结合缓冲液重悬的细胞,以评估自身荧光水平,并相应地调整仪器;
单染管:分别用Annexin V-FITC或碘化丙啶(PI)染色,以确定每个细胞群体的边界。
2. 如使用含EDTA的胰酶消化细胞时,有必要在染色之前用PBS或结合缓冲液洗涤细胞两次以去除EDTA,从而避免螯合Annexin V所必需的Ca2+;
3. 流式细胞仪检测时,使用FITC通道(通常是FL1)检测Annexin V-FITC;phycoerythrin通道(通常是FL2)检测PI。用CellQuest等软件进行分析,以FITC为横坐标,PI为纵坐标,绘制双色散点图(two-color dot plot);
4. 建议细胞在染色后1h之内完成检测;
5. 实验操作过程需尽量轻柔,从而最大限度地保留凋亡的细胞;
6. 试剂在开盖前请短暂离心,将管盖及内壁上的液体甩至管底,以避免开盖时液体洒落;
7. Annexin V-FITC和PI是光敏物质,在操作时请注意避光;
8. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
9. 本产品仅限科研使用。
总篇数:加载中...
总影响因子:加载中...
最高影响因子:加载中...