BCA蛋白定量法是目前广泛使用的蛋白定量方法之一。本产品是基于BCA(Bicin-choninic Acid)法研制而成,实现了对蛋白质进行快速、稳定、灵敏的浓度测定。其原理是在碱性环境下蛋白质分子中的肽链结构能与Cu2+络合生成络合物,同时将Cu2+还原成Cu+,BCA试剂可敏感特异地与Cu+结合,形成稳定的有颜色的复合物,其在562nm处有高的光吸收值,颜色的深浅与蛋白质浓度成正比,可根据吸收值的大小来测定蛋白质的含量。本试剂盒含有牛血清白蛋白(BSA)溶液作为蛋白质标准品溶液,测定范围为20~2,000μg/mL。
试剂A
试剂B
BSA标准品(5mg/mL)
100mL
3mL
1mL
100mL×5
3mL×5
1mL×5
准确性高
变异系数远小于考马斯亮蓝染色法线性范围宽
灵敏,检测范围:20~2,000 μg/mL兼容性好
与金属离子、还原剂、螯合剂及去污剂兼容性较好稀释BSA标准品:
取120μL蛋白标准品(需完全融解),用与待测蛋白样品相一致的稀释液稀释至300μL,使终浓度为2mg/mL。
注意:为方便起见,也可以用0.9%生理盐水或PBS缓冲液稀释标准品。
配置显色工作液:
a. 计算显色工作液总量:
工作液总量 = (BSA标准品样本个数+待测样本个数)×复孔数×每个样本显色工作液体积
举例:BSA标准品样本个数为9个,待测样本个数3个,复孔数3个。
显色工作液总量 = (9个BSA标准品样本+3个待测样本)×3个复孔×200μL(每个样本工作液体积) = 7.2 mL
b. 根据计算出的所需显色工作液用量,将试剂A和试剂B按照50:1的体积比,配制显色工作液,充分混匀:
注意:
⑴由于加样可能存在误差,建议配制BCA工作液时,多配制1~2个孔的量;
⑵新配制的BCA工作液室温密封条件下可稳定保存24h。
定量检测:
① 将稀释后的标准品按 0,1,2,4,6,8,10,15,20μL分别加到96孔板中,加入用于稀释标准品的溶液补足到20μL(为避免枪尖损失,可先补足稀释液后加入标准品)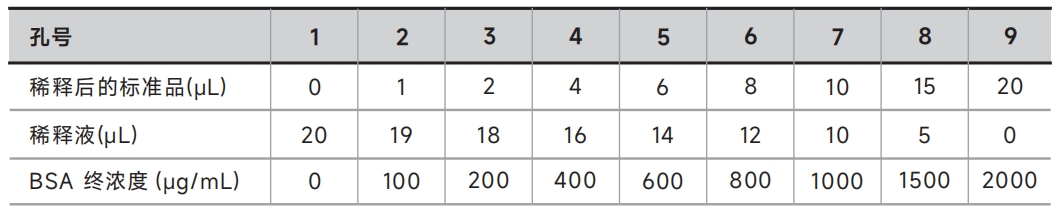
② 将样品适当稀释(可以多作几个梯度,如 2倍、4倍、8倍稀释),加20μL到 96 孔板的样品孔中;
③ 各孔加入200 μL显色工作液,充分混匀,盖上96孔板盖,37℃孵育30 min,冷却至室温;
注意:也可以室温放置2h,或60℃放置30min。BCA法测定蛋白浓度时,吸光度会随着时间的延长不断加深。并且显色反应会因温度升高而加快。如果蛋白浓度较低,可在较高温度孵育,或延长孵育时间。
④ 用酶标仪测定每个样品及BSA标准品的A562,或540~590 nm之间的其它波长的吸光度,注意要减去空白对照(稀释液+工作液)的吸光度。
⑤ 绘制标准曲线,计算样品中的蛋白浓度。
注意:数据处理时需要去除明显错误的值。待测样品浓度可以从标准曲线中查得, 实际浓度需要乘以样品的稀释倍数。如果是计算机绘制的曲线,可以从计算机给出的线性方程式计算出待测样品的浓度。
1. 本产品可以采用酶标仪(微孔检测法)或者分光光度计(试管检测法)测定蛋白浓度,如使用普通的分光光度计测定,需根据比色皿的最小检测体积,适当加大BCA工作液的用量使其不小于最小检测体积,样品和标准品的用量可相应按比例放大。使用分光光度计测定蛋白浓度时,每个试剂盒可以测定的样品数量可能会显著减少;
2. 试剂在低温条件或长期保存出现沉淀时,可搅拌或37℃温育使其溶解;
3. 建议每次测定蛋白样品时,都须绘制标准曲线,以获得准确数据;
4. BSA标准品的稀释液需与待测样品的稀释液一致(可用1×PBS或0.9%生理盐水进行稀释);
5. 如待测样品中含较多的干扰物质(具体见附表),可采用其它蛋白定量产品;
6. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
7. 本产品仅限科研使用。

总篇数:加载中...
总影响因子:加载中...
最高影响因子:加载中...